
Direktorat Standardisasi Obat, Narkotika, Psikotropika, Prekursor, dan Zat Adiktif merupakan salah satu unit kerja di lingkungan Badan POM yang berperan dalam menyusun kebijakan di bidang pengawasan obat, narkotika, psikotropika, prekursor dan zat adiktif. Kebijakan tersebut disusun berlandaskan data-data, kajian dan peraturan/ketentuan yang berlaku (evidence-based policy) dengan melibatkan seluruh pemangku kepentingan, termasuk unit kerja terkait. Dengan demikian, diharapkan akan dihasilkan kebijakan yang efektif dan bermanfaat, terutama untuk menyelesaikan berbagai permasalahan publik dalam rangka perlindungan masyarakat serta peningkatan daya saing bangsa.
Kebijakan yang disusun meliputi regulasi peraturan perundang-undangan, pedoman, norma, standar, prosedur, kriteria dan kajian yang mendukung peningkatan efektivitas/ penguatan pengawasan Obat. Dalam menjalankan perannya sebagai penyusun kebijakan, Direktorat Standardisasi Obat, Narkotika, Psikotropika, Prekursor, dan Zat Adiktif mampu memastikan optimalisasi pemanfaatan kebijakan yang telah disusun, baik secara internal maupun eksternal Badan POM. Dengan pemanfaatan kebijakan pengawasan Obat yang tinggi, diharapkan masyarakat akan semakin terlindungi dari obat yang tidak memenuhi syarat keamanan, khasiat/manfaat, dan mutu.
(Sumber: Ringkasan Eksekutif Laporan Kinerja Direktorat Standardisasi Obat, Narkotika, Psikotropika, Prekursor, dan Zat Adiktif Tahun 2019)
Visi
Obat dan Makanan aman, bermutu, dan berdaya saing untuk mewujudkan Indonesia maju yang berdaulat, mandiri, dan berkepribadian berlandaskan gotong royong
Misi
- Membangun SDM unggul terkait Obat dan Makanan dengan mengembangkan kemitraan bersama seluruh komponen bangsa dalam rangka peningkatan kualitas manusia Indonesia
- Memfasilitasi percepatan pengembangan dunia usaha Obat dan Makanan dengan keberpihakan terhadap UMKM dalam rangka membangun struktur ekonomi yang produktif dan berdaya saing untuk kemandirian bangsa
- Meningkatkan efektivitas pengawasan Obat dan Makanan serta penindakan kejahatan Obat dan Makanan melalui sinergi pemerintah pusat dan daerah dalam kerangka Negara Kesatuan guna perlindungan bagi segenap bangsa dan memberikan rasa aman pada seluruh warga
- Pengelolaan pemerintahan yang bersih, efektif, dan terpercaya untuk memberikan pelayanan publik yang prima di bidang Obat dan Makanan
Budaya Organisasi
Budaya organisasi merupakan nilai-nilai luhur yang diyakini dan harus dihayati dan diamalkan oleh seluruh anggota organisasi dalam melaksanakan tugas. Nilai-nilai luhur yang hidup dan tumbuh kembang dalam organisasi menjadi semangat bagi seluruh anggota organisasi dalam berkarsa dan berkarya.
Profesional
Menegakkan profesionalisme dengan integritas, objektivitas, ketekunan dan komitmen yang tinggi.
Integritas
konsistensi dan keteguhan yang tak tergoyahkan dalam menjunjung tinggi nilai-nilai luhur dan keyakinan
Kredibilitas
Dapat dipercaya dan diakui oleh masyarakat luas, nasional dan internasional.
Kerjasama Tim
Mengutamakan keterbukaan, saling percaya dan komunikasi yang baik.
Inovatif
Mampu melakukan pembaruan sesuai ilmu pengetahuan dan teknologi terkini.
Responsif/Cepat Tanggap
Antisipatif dan responsif dalam mengatasi masalah.
Tugas
Direktorat Standardisasi Obat, Narkotika, Psikotropika, Prekursor, dan Zat Adiktif mempunyai tugas melaksanakan penyusunan dan pelaksanaan kebijakan, penyusunan norma, standar, prosedur, kriteria, pelaksanaan bimbingan teknis dan supervisi, serta pemantauan, evaluasi, dan pelaporan di bidang standardisasi obat, bahan obat, narkotika, psikotropika, prekursor, dan zat adiktif.
Fungsi
-
Penyiapan penyusunan kebijakan di bidang standardisasi keamanan, khasiat, mutu, informasi produk, produksi dan distribusi obat, bahan obat, narkotika, psikotropika, prekursor, dan zat adiktif
-
Penyiapan pelaksanaan kebijakan di bidang standardisasi keamanan, khasiat, mutu, informasi produk, produksi dan distribusi obat, bahan obat, narkotika, psikotropika, prekursor, dan zat adiktif
-
Penyiapan penyusunan norma, standar, prosedur, dan kriteria di bidang standardisasi keamanan, khasiat, mutu, informasi produk, produksi dan distribusi obat, bahan obat, narkotika, psikotropika, prekursor, dan zat adiktif;
-
Pemberian bimbingan teknis dan supervisi di bidang standardisasi keamanan, khasiat, mutu, informasi produk, produksi dan distribusi obat, bahan obat, narkotika, psikotropika, prekursor, dan zat adiktif
-
Pelaksanaan pemantauan, evaluasi, dan pelaporan di bidang standardisasi keamanan, khasiat, mutu, informasi produk, produksi dan distribusi obat, bahan obat, narkotika, psikotropika, prekursor, dan zat adiktif
-
Pelaksanaan urusan tata operasional direktorat.
Profil Organisasi
Budaya organisasi merupakan nilai-nilai luhur yang diyakini dan harus dihayati dan diamalkan oleh seluruh anggota organisasi dalam melaksanakan tugas. Nilai-nilai luhur yang hidup dan tumbuh kembang dalam organisasi menjadi semangat bagi seluruh anggota organisasi dalam berkarsa dan berkarya.
Profesional
Menegakkan profesionalisme dengan integritas, objektivitas, ketekunan dan komitmen yang tinggi.
Integritas
konsistensi dan keteguhan yang tak tergoyahkan dalam menjunjung tinggi nilai-nilai luhur dan keyakinan
Kredibilitas
Dapat dipercaya dan diakui oleh masyarakat luas, nasional dan internasional.
Kerjasama Tim
Mengutamakan keterbukaan, saling percaya dan komunikasi yang baik.
Inovatif
Mampu melakukan pembaruan sesuai ilmu pengetahuan dan teknologi terkini.
Responsif/Cepat Tanggap
Antisipatif dan responsif dalam mengatasi masalah.
Struktur Organisasi
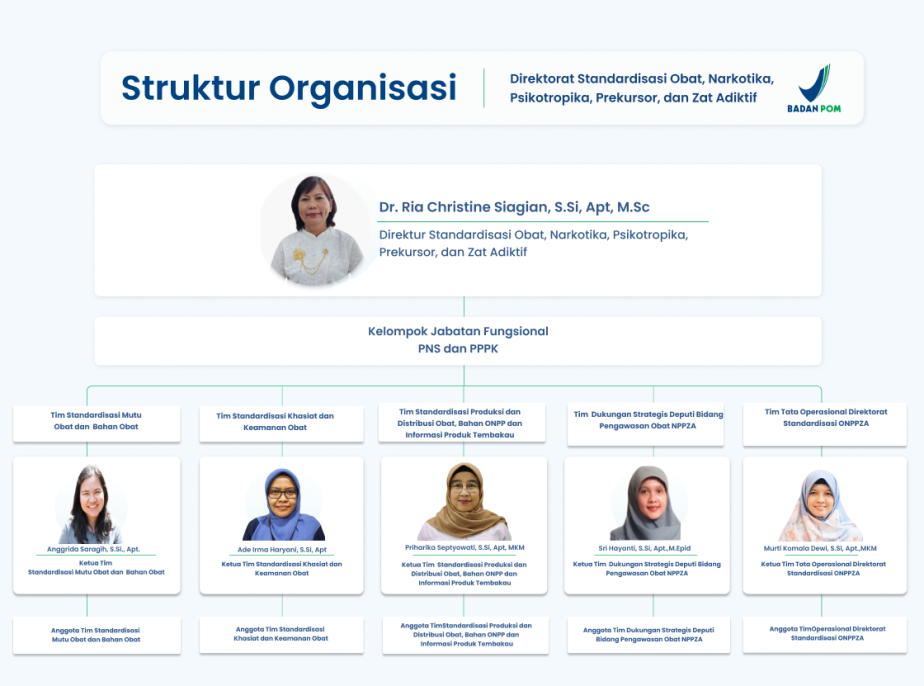

Profil Dr. Ria Christine Siagian, S.Si, Apt, M.Sc
Dr. Ria Christine Siagian, S.Si., Apt., M.Sc. memulai kariernya di BPOM pada tahun 1999 sebagai Evaluator di Direktorat Registrasi Obat, dan telah berpengalaman dalam evaluasi obat generik, produk biologi, obat baru dan uji klinik. Penerima Satya Lencana Karya dari Presiden ini pernah menjabat sebagai Kepala Seksi Uji Klinik, Plt. Direktur Standardisasi Obat Tradisional, Suplemen Kesehatan, dan Kosmetik serta Direktur Registrasi Obat periode 2023-2025 sebelum dilantik sebagai Direktur Standardisasi Obat NPPZA pada 29 September 2025. Selain itu, beliau pernah menjadi fasilitator pelatihan Good Clinical Practice (GCP), GCP Inspection dan Clinical Trial Authorization (CTA) WHO Global Learning Opportunities (GLO) dan Principal Content Developer dalam pembelajaran daring GCP Inspection yang merupakan kolaborasi WHO–BPOM.
Di dunia akademisi, peraih gelar Doktor bidang Health Policy dari Universitas Indonesia, Magister Biopharmaceutical Science dari The University of New South Wales, serta Apoteker dan Sarjana Farmasi dari Universitas Indonesia, memiliki publikasi ilmiah di berbagai jurnal internasional bereputasi seperti PLOS ONE, International Journal of Health Governance, World Medical and Health Policy, TechTrends dan Vaccine dengan fokus pada kebijakan pengembangan obat, kemandirian farmasi, dan inovasi riset farmasi di negara berkembang.
Sebagai Direktur Standardisasi Obat NPPZA, Dr. Christine berkomitmen untuk menegakkan transparansi, akuntabilitas, dan pelayanan informasi publik yang responsif dan inovatif, guna mewujudkan good governance di Zona Integritas menuju Wilayah Birokrasi Bersih dan Melayani (WBBM) BPOM, serta menjadikan Direktorat Standardisasi Obat NPPZA sebagai pusat pemikiran strategis (think tank) untuk mewujudkan visi menjulang, membumi dan mengakar yang diusung oleh Kepala BPOM.
